核心提示:我校彭健教授团队针对肠道健康开展系统深入的研究,揭示了肠道中核受体Nur77调控潘氏细胞稳态的作用和分子机制及潘氏细胞在抵抗呕吐毒素诱导的肠道炎症中的作用。
(通讯员:崔琛彬、魏宏逵)我校彭健教授团队针对潘氏细胞在肠道炎症发生中的作用及其调控领域开展系统深入的研究,连续在国际学术期刊Mucosal Immunology、Ecotoxicology and Environmental Safety、Journal of Animal Science and Biotechnology和Frontiers in Immunology发表系列研究论文,揭示了核受体Nur77调控潘氏细胞分化和功能的作用和机制,以及肠道潘氏细胞在抵抗感染性和非感染性肠道炎症的作用,为养猪生产中控制肠道炎症、改善肠道健康提供新的思路和靶点。
肠道上皮在维持肠道稳态中起着重要作用。潘氏细胞是肠道先天免疫的重要组成部分,是肠道的守护者。一方面,潘氏细胞能够分泌抗菌肽以调控肠道微生物,另一方面能够支持干细胞功能。当潘氏细胞紊乱时,不仅会导致肠道疾病,还会加剧肠外器官的疾病,包括肝脏疾、急性胰腺炎和肥胖等。
近日,该团队在国际黏膜免疫研究的顶级刊物《Mucosal Immunology》杂志上,发表了题为“Nur77 as a novel regulator of Paneth cell differentiation and function”的研究论文。该研究确定了核受体Nur77是一种新的潘氏细胞分化和功能调节因子。当Nur77缺失时,不仅会导致小鼠回肠隐窝中潘氏细胞的损失;而且Nur77缺失的肠道组织或类器官表现出肠道干细胞生态位受损和在潘氏细胞脱颗粒后抗菌肽表达受损。值得注意的是,Nur77敲除后,小鼠的潘氏细胞和抗菌肽缺陷导致肠道微生物群紊乱。因此,Nur77缺失会使出生后的小鼠大大增加患坏死性小肠结肠炎的发生率和严重程度。从机制上讲,Nur77转录抑制Dact1的表达以激活Wnt信号活性,从而促进Paneth细胞的分化和功能。总之,该研究表明,Nur77在潘氏细胞分化和功能中发挥着重要的调节作用;并揭示了在潘氏细胞分化过程中一种新的Dact1介导的Wnt抑制模式。这项研究首次发现了调控潘氏细胞分化和功能的新蛋白Nur77,为养猪生产中利用Nur77激动剂改善肠道健康提供了理论支持。

图1 Nur77是一种新的潘氏细胞分化和功能调节蛋白
另外,脱氧雪腐镰刀菌烯醇(DON)又称呕吐毒素,因为可以引起猪的呕吐而得名。全球生产的饲料中至少45%污染了已知的霉菌毒素,其中DON的检出率最高。DON会引发严重的小肠损伤和炎症,对人畜均有非特异性毒性作用。DON污染会减少潘氏细胞数量,而潘氏细胞在DON诱导的肠道损伤中的作用尚不清楚。该团队日前在《Ecotoxicology and Environmental Safety》杂志上发表了题为“Paneth cells protect intestinal stem cell niche to alleviate deoxynivalenol-induced intestinal injury”的论文,首次揭示了潘氏细胞在抵抗呕吐毒素诱导的肠道损伤中的发挥了关键保护作用。该研究建立了双硫腙处理减少小鼠潘氏细胞的模型。结果发现:潘氏细胞被破坏后,加重了DON(2 mg/kg)攻毒小鼠的肠道损伤、肠道干细胞损失和微生物群紊乱。在双硫腙和DON处理后,厚壁菌门/拟杆菌门的比例降低,并且在小鼠中观察到Dubosiella丰度增加和Lactobacillus丰度降低。而通过补充溶菌酶(200U/天)恢复潘氏细胞的功能后,则会改善DON攻毒后小鼠的肠道损伤和干细胞损失,并促进肠道类器官的生长和干细胞活性。围绕潘氏细胞在调控肠道稳态中的作用,该团队还发表了一系列的综述性论文,系统论述了潘氏细胞分化、功能和死亡在肠道炎症发生中的作用和机制,并提出通过靶向调节潘氏细胞防治人类和畜禽肠道炎症的可能性。
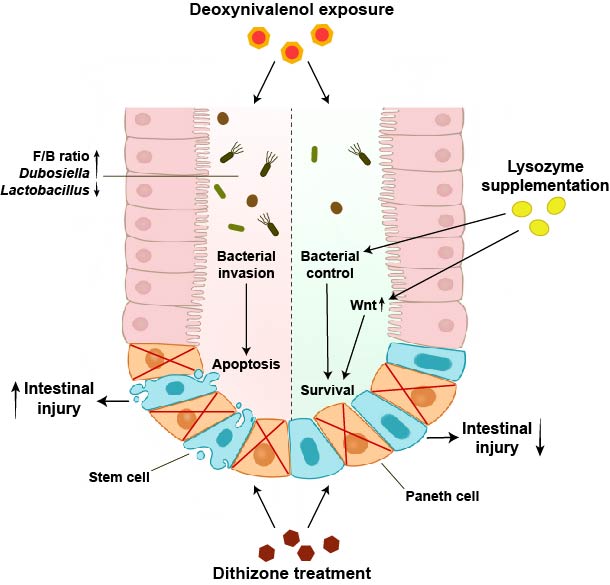
图2 潘氏细胞保护肠道干细胞以减轻呕吐毒素诱导的肠道损伤
安博·体育(China)官方网站动物科学技术学院、动物医学院博士生崔琛彬为该系列论文第一作者,彭健教授为论文通讯作者。本系列研究受国家自然科学基金(U22A20511、31972578)、现代农业产业技术体系(CARS-36)和动物育种与健康养殖前沿科学中心的资助。
审核:彭健
【代表性论文英文摘要】
Serving as a part of intestinal innate immunity, Paneth cells plays an important role in intestinal homeostasis maintenance via their multiple functions. However, the regulation of Paneth cells has been proved to be complex and diverse. Here, we identified nuclear receptor Nur77 as a novel regulator of Paneth cell differentiation and function.Nur77deficiency led to the loss of Paneth cells in murine ileal crypts. Intestinal tissues or organoids withNur77deficiency exhibited the impaired intestinal stem cell (ISC) niche and failed to enhance antimicrobial peptide (AMP) expression after Paneth cell degranulation. The defects in Paneth cells and AMPs inNur77-/-mice led to intestinal microbiota disorders.Nur77deficiency rendered postnatal mice susceptible to necrotizing enterocolitis (NEC). Mechanistically, Nur77 transcriptionally inhibitedDact1expression to activate Wnt signaling activity, thus promoting Paneth cell differentiation and function. Taken together, our data suggest the regulatory role of Nur77 in Paneth cell differentiation and function and reveal a novel Dact1-mediated Wnt inhibition mechanism in Paneth cell development.
代表性论文链接:
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1122258/full
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1115552/full
https://jasbsci.biomedcentral.com/articles/10.1186/s40104-023-00905-5

